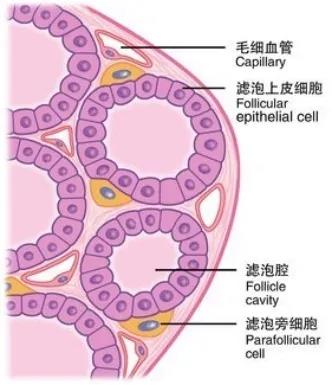
摘要 甲状腺乳头状癌(PTC)在女性中有较高的发病率,且女性PTC发病率受年龄等因素影响,这提示雌激素/雌激素受体(ERs)在PTC中发挥独特作用,多数研究证明ERα表达与PTC成正相关性,而ERβ与PTC发生呈负相关。且在PTC进程中雌激素可对ERs表达及肿瘤微环境造成影响。调控雌激素/ERs在PTC中的表达已经成为雌激素相关肿瘤治疗中重要的一部分。分析PTC女性发病的特点,探索不同ERs在甲状腺肿瘤中的作用,可为治疗疾病提供新的思路。 【关键词】女性;甲状腺乳头状癌;雌激素;雌激素受体 前言 甲状腺癌近年来在全球范围内的发病率持续上升,虽然在过去的5年里,甲状腺癌的死亡率变化很小,但在女性肿瘤发生中排名仍居第6位,77%甲状腺癌患者为女性[1]。分化型甲状腺癌(differentiated thyroid carcinoma,DTC)是甲状腺癌中最常见的亚型,占90%以上,起源于甲状腺滤泡上皮细胞,主要包括乳头状甲状腺癌(papillary thyroid cancer,PTC)和滤泡型甲状腺癌,少数为Hurthle细胞或嗜酸性细胞肿瘤[1]。 美国癌症联合委员会(AJCC)第8版/TNM分化型甲状腺癌分类系统将分为T0, T1a, T1b, T2, T3, T4a, T4b, N0, N1a, N1b, M0, M1;当TNM-8应用时,Ⅰ、Ⅱ、Ⅲ和Ⅳ期的10年疾病特异性生存率分别为99.6%、95.4%、72.3%和48.6%[2]。2022年世界卫生组织(WHO)甲状腺肿瘤分类提出PTC分为8个亚型:浸润性滤泡型、高细胞型、柱状细胞型、鞋钉型、实体型、弥漫性硬化型、Warthin样型、嗜酸瘤细胞型[3]。现有的研究认为PTC的侵袭性变异包括鞋钉状、高细胞、柱状和实性,某些变异的PTC可能表现比典型的PTC更具侵略性。其中PTC的高细胞变异是PTC最常见的侵袭性变异,高细胞变异的PTC比典型的PTC表现出更高的复发率和更低的疾病特异性生存期[4]。 PTC在DTC中最常见,而PTC在女性中有较高的发病率,提示PTC可能受性激素尤其是雌激素的调节,而雌激素受年龄、绝经等因素影响,推测雌激素可能为PTC的危险因素。虽然PTC死亡率低,但疾病复发率高,在某些亚组患者中高达20%~30%,因此急需对PTC靶向、精准、个体化治疗方案进行探究,对个体进行精准评估有助于平衡治疗本身带来的益处与危害。越来越多的研究表明抗雌激素治疗已经成为雌激素相关肿瘤治疗中重要的一部分。近年,在某些传统上被认为非激素靶器官的一些实体肿瘤组织中,包括甲状腺癌、胃癌、结肠癌、胆囊癌的肿瘤也屡有检出雌激素受体(estrogen receptors,ERs)。但目前内分泌治疗还未应用于PTC,因此对雌激素/ERs在PTC中发挥的作用及机制进行深入探讨,有利于指导内分泌治疗在PTC中的应用,以挖掘PTC的新型治疗策略。本文就女性PTC临床特征以及ERs在PTC中的作用展开更具体的讨论。 01 女性PTC临床特征 1.1 女性PTC发病率 甲状腺癌是最常见的内分泌恶性肿瘤,其中77%为女性,且其中大约90%的甲状腺癌是DTC,DTC中90%为PTC。1990—2019年,我国甲状腺癌发病率从10 030例上升到39 080例,预计到2039年将上升到3.37/10万人年[5]。 1.2 女性PTC发病与年龄 多数文献显示女性PTC的发病率通常在40~59岁左右达到高峰,一项美国SEER临床研究对2000—2016年于20~49岁(n=61 552)被诊断为PTC的女性进行研究,表明45~59岁年龄段女性更易患PTC[6]。但现有研究表明女性绝经后PTC发病率下降,但绝经妇女若患PTC,则其更具侵袭性,预后更差[7]。因此推测女性PTC发病与雌激素存在关联。 1.3 女性PTC的危险因素 女性易患甲状腺癌的危险因素目前仍未有明确推断,在多变量分析中,女性易发生PTC的独立危险因素包括患有糖尿病、高血压、高槟榔摄入和食用红肉,而体重过轻似乎是有保护作用的。在女性中,较高的体重、身高、体重指数、腰围和腰臀比与PTC风险显著增加相关。然而,在男性中,同样的人体测量变量并不影响PTC的风险[8]。 02 雌激素/ ERs 在 PTC 中的作用及机制 ERs是一种蛋白质分子,可与激素发生特异性结合而形成激素-受体复合物,使激素发挥其生物学效应。而ERs是雌激素作用的靶位点,在相关信号通路中起主要作用,参与调节和维持生命体的基本活动,经典的核受体包括ERα和ERβ[9],它们位于细胞核内,介导雌激素的基因型效应——通过调节特异性靶基因的转录而发挥“基因型”调节效应。一项实时荧光定量聚合酶链反应(RT-qPCR)检测ER mRNA表达水平与PTC临床病理特征的关系的实验表示:ERα66、ERα36、ERβ和G蛋白偶联雌激素受体1(GPER1)在PTC中表达低于邻近正常甲状腺组织,且与甲状腺外延伸有关[10]。 在细胞膜上,ERα和ERβ可以与支架蛋白相互作用,如小穴蛋白-1和MNAR/PELP-1(ERs非基因组活性调节剂)。ERα和ERβ也与G蛋白、各种膜受体(如酪氨酸激酶、胰岛素生长因子1和表皮生长因子受体)和信号分子相互作用,包括位于膜上或膜附近的RAS、非受体酪氨酸激酶(Src)和PI3激酶、酪氨酸激酶受体2(ErbB2或HER-2/neu)和衔接蛋白(Shc)。与这些分子的相互作用促进细胞内丝裂原活化蛋白激酶(MAPK)和蛋白激酶B(Akt)信号通路的激活,从而影响转录调节[9]。 2.1 雌激素/ERs信号与PTC 2.1.1 PTC中雌激素/ERα信号通路作用机制 多数研究证明ERα表达与PTC成正相关性,ERα促进PTC进程的机制研究较多,有不同的推测:IQGAP1作为信号整合因子,介导ERα转录活性从而促进细胞增殖和细胞侵袭。现有文章证明了在PTC细胞中过表达微小RNA-1280(miR-1280)可能通过抑制ERα促进细胞增殖和侵袭,也可能是miR-1280水平通过抑制ERα,从而促进肿瘤细胞增殖和侵袭[11]。一项研究发现ERα调控的以LAMP2A表达为标志的分子伴侣介导的自噬(chaperone mediated autophagy,CMA)促进PTC肿瘤进展,通过靶向过氧化物酶体增殖物激活受体γ(PPARγ)-基质细胞衍生因子-1/趋化因子受体4(SDF-1/CXCR4)信号通路增强肿瘤细胞的增殖和迁移,为治疗PTC提供了可能的靶点[12]。此外,一项研究证实PTC组织中组蛋白甲基化酶2(EZH2)的表达率高于正常甲状腺组织,并与淋巴结转移及复发有关。ERα介导PTC细胞中EZH2表达水平上调,从而促进PTC细胞的增殖与转移[13];同时高表达的ERα36、GPER1和人表皮生长因子受体-2(HER-2)与侵袭性行为[包括甲状腺外扩张(ETE)、淋巴结转移(LNM)和高TNM分期]密切相关[9]。另有研究表明ERα受到雌激素刺激后迅速激活细胞周期进展和抵抗凋亡相关的多个信号转导通路细胞外调节蛋白激酶(ERK)/MAPK和磷脂酰肌醇三激酶(PI3K)/Akt。雌激素也可通过ERα/特异性蛋白1(SP1)介导的热休克蛋白27(Hsp27)上调促进PTC细胞增殖。ERα/SP1通过与半胱天冬酶-3酶原(procaspase-3)相互作用上调Hsp27,促进细胞增殖和抵抗凋亡[14]。此外,ERα还可以与其他转录调节剂相互作用,如激活转录因子(ATF)-2、氨基末端激酶(c-jun)、ATF-1/环磷酸腺苷反应元件结合蛋白(CREB)和核转录因子-Y(NF-Y)[9]。笔者推测通过抗激素治疗、芳香酶抑制剂等抑制雌激素生成,从而影响PPARγ-SDF1/CXCR4、ERK/MAPK、PI3K/AKT等信号通路来抑制ERα上调,可能抑制PTC肿瘤细胞的增殖与转移,但其仍需进一步临床实验来验证。 2.1.2 PTC中雌激素/ERβ信号通路作用机制 目前ERβ影响PTC的机制研究尚未明确定论,ERβ亚型可分为ERβ1和C端截尾剪接异体ERβ2,对于ERβ,多数研究表明PTC的发生与ERβ的低表达有相关性[9]。一项关于ERβ亚型与PTC关系的研究表明:与结节性甲状腺肿组织相比,PTC病变中细胞核内和胞浆核内ERβ1的表达均显著低于结节性甲状腺肿组织,而ERβ2在PTC中的表达则显著高于结节性甲状腺肿组织[15]。另一项研究证明一种包含乳腺癌1号基因(BRCA1)C末端结构域(BRCT)的蛋白核糖体生物发生因子1(PES1),能通过提高ERα蛋白水平和降低ERβ蛋白水平,进而上调ERα/ERβ蛋白比值,促进PTC的发生发展[16]。ERβ则诱导p38/MAPK的快速和持续的磷酸化,参与caspase-3的激活和poly(adp-核糖)聚合酶的裂解,驱动细胞进入凋亡周期[17]。ERβ影响PTC的机制有研究推测可能是雌激素通过ERβ显著促进长链非编码RNA-H19(lncRNA-H19)的转录。即ERβ-H19正反馈环在维持甲状腺癌乳头状干细胞方面发挥着重要作用[18]。ERs表达与育龄女性PTC患者Ki-67、突变型P53/ target=_blank class=infotextkey>P53、血管内皮生长因子(VEGF)表达及ETE的相关性提示雌激素激活ERβ1对PTC具有一定的抑制作用[9]。总而言之,PTC的发生与ERβ的低表达有相关性,提高ERβ的表达水平,促进p38/MAPK、lncRNA-H19等表达,或可预防PTC的发生。如何提高ERβ的研究仍有待进一步的研究与挖掘。 2.2 PTC进程中雌激素对ERs表达及肿瘤微环境的影响 2.2.1 雌激素调控ERs的表达 Manole等[19]证实了雌激素对PTC细胞有直接刺激生长作用,他们发现雌激素增强了甲状腺细胞中ERα,ERβ和cyclin D1蛋白的表达,导致PTC增殖率的增加,并可被雌激素受体拮抗剂所拮抗。而另有研究表明雌激素可能影响人类甲状腺的发育、生理和病理,而这些作用通过ERα在肿瘤中更为明显,但雌激素对PTC细胞生长的影响取决于ERα和ERβ之间的平衡[20]。虽然在女性PTC高发年龄为青中年,但绝经妇女若患PTC,则其预后更差,推测这可能是绝经后雌激素下降,但甲状腺组织中代偿性ERα增加所致。雌激素影响ERs的表达目前有多种推测:在一项模拟PTC类器官模型的研究中,PTC类器官的药物敏感性分析显示雌激素能通过ERα促进PTC类器官细胞增殖,而与ERβ和GPER1的表达无关[21]。另一项研究发现维生素D类似物可以影响ERs的表达,尤其是ERβ,而ERs的表达反过来又参与雌激素诱导的细胞生长,因而抑制PTC的生长[22]。因此笔者推测服用维生素D类似物等可促进ERs的表达,尤其是ERβ,可用于PTC的辅助治疗。 2.2.2 雌激素对PTC肿瘤微环境的影响 近几年对雌激素与PTC肿瘤微环境的关系研究较少,早期研究证明雌激素主要通过对肿瘤细胞的直接基因组和非基因组效应影响肿瘤微环境,同时也可以通过免疫抑制和其他机制,如血管生成、缺氧和炎症等促进恶性肿瘤的进展。现有的一项研究表明抗雌激素激素治疗可能会减少表达ERα的滤泡树突状细胞的数量,从而通过影响肿瘤的微环境,作用与PTC的进程[20]。另有研究表明在雌激素通过β-黏附连接蛋白67(β-catenin 67)和基质金属蛋白酶(MMP)-9影响TC的增殖、黏附、侵袭和迁移。同样,E-钙黏蛋白下调和β-catenin易位可维持TC细胞的转移活性[23]。而另有些报道称雌激素可通过VEGF信号通路、缺氧诱导因子-1(HIF-1)信号通路、核转录因子κB(NF-κB)信号通路改变肿瘤微环境,从而影响肿瘤的发生[24]。雌激素对PTC肿瘤微环境的影响及其作用机制仍有待进一步挖掘。 03 外源性激素与PTC 几项大型研究研究了激素替代疗法与PTC风险之间的关系,但目前仍存在一定争议。一项研究结果暗示了氯米酚(外源性雌激素)的使用和甲状腺癌之间的潜在联系。氯米酚暴露的妇女发生PTC风险增加的可能机制尚不清楚,但推测可能与卵巢刺激引起的雌激素过多有关[25]。然而另外有一些研究认为,在绝经后妇女中使用雌激素不会改变癌症风险,且绝经后妇女在避孕药和替代疗法中使用低剂量雌激素并不会增加甲状腺癌的风险[26]。另外,目前抗雌激素治疗在PTC中的应用仍未有过多的研究,有待进一步的探索与研究。 04 总结与展望 综上所述,众多研究表明雌激素参与了女性PTC的进程,不同的ERs对PTC的发生发挥不同的作用,多数研究表明ERα表达与PTC正相关性,而ERβ与PTC发生呈负相关,且在PTC进程中雌激素可对ERs表达及肿瘤微环境造成影响,调控雌激素/ERs的表达可影响PTC的进展。多数研究认为雌激素与PTC的发生有潜在联系,然而抗雌激素治疗在PTC中的应用仍有待进一步研究,因此继续探索雌激素/ERs在PTC中的作用,可为治疗疾病提供新的思路,同时可为个体化差异治疗提供理论和实验依据。 因此,抗雌激素治疗未来可能成为治疗PTC的有效途径。同样芳香化酶抑制剂阻断雌激素在周围组织和肿瘤内的生成,也可能用于治疗PTC。另外,从雌激素/ERs作用的分子机制和进展可以得到治疗PTC的另一种策略为选择性靶向ERs,即抑制ERα或促进ERβ从而抑制PTC肿瘤细胞的增殖与转移。这包括与ERs密切相关激活剂或抑制剂的使用,或利用去甲基化制剂、小干扰RNA等方法对ERs及其共激活子和共抑制子的进行转录表达、修饰和降解等。未来对雌激素/ERs转录激活作用的分子机制更深入的研究有助于发掘PTC更有效、系统的治疗策略。